Внутричерепные образования с высоким сигналом на Т1 взвешенных изображениях: дифференциальная диагностика
Введение
T1 (спин-решеточная) релаксация представляет собой процесс восстановления продольной намагниченности после применения радиочастотного импульса или возбуждения для инверсии вектора намагниченности [1,2]. Этот процесс происходит, когда энергия от вращающихся ядер рассеивается в окружающие области. T1 - время, необходимое для того, чтобы спины восстанавливали приблизительно 63% их продольной намагниченности. Вещества, которые имеют существенно более короткие времена T1 релаксации, демонстрируют более высокую интенсивность сигнала при T1-взвешенном изображении. Конкретный эффект взвешивания T1 на внешний вид изображения вещества зависит от времени повторения (TR), времени эха (TE), плотности протонов и напряженности магнитного поля [1,2].
Известно, что только несколько встречающихся в природе веществ уменьшают времена релаксации T1, и степень этого восстановления зависит от их возникновения в значительных концентрациях. Эти вещества включают метгемоглобин, меланин, липид, белок и минералы, однако в некоторых случаях высокая интенсивность сигнала, наблюдаемая при поражении, не была окончательно связана с каким-либо из этих веществ. Тем не менее, знакомство с воздействием химического состава на интенсивность сигнала T1 облегчает дифференциальную диагностику повреждений, которые имеют высокую интенсивность сигнала на T1-взвешенных изображениях.
NB данная статья является авторским переводом публикации Daniel T. Ginat, MD,MS, and Steven P. Meyers, MD, PhD Intracranial Lesions with High Signal Intensity on T1-weighted MR Images: Differential Diagnosis. RadioGraphics 2012; 32:499–516 Published online 10.1148/rg.322105761 [74]
Классификация внутричерепных поражений гиперинтенсивных по Т1
- в соответствии с содержимым образования
- метгемоглобин
- меланин
- метастаз меланомы, первичный диффузный менингиальный меланоматоз, меланоцитома, нейрокожный меланоз
- липиды
- липома, остеолипома, тератома, дермоид, липоматозные опухоли (менингиома, астроцитома, медулобластома, нейроцитома, эпендимома, гамартома гипоталамуса), метапластическая оссификация твердой мозговой оболочки
- белок
- минералы
- кокаиновый синдром, синдром Фара (гипопаратиреоидизм, псевдопаратиреоидизм, бурые опухоли), нейродегенеративные изменения с накоплением железа, болезнь Фабри, печеночная энцефалопатия, болезнь Вильсона, гипермагниемия
- прочие
- ВИЧ инфекция, нейрофиброматоз I типа, холестериновая гранулема, краниофарингиома, кортикальный ламинарный некроз, гипоксическая ишемическая энцефалопатия, рассеянный склероз (хроническое течение), хордома, абсцесс, гипергликемическая кома
- в зависимости от локализации
- глубокое серое вещество
- кокаиновый синдром: зубчатые и чечевицеобразные ядра
- пантотенат киназа-ассоцированная нейродегенерация: двустороннее в бледных шарах и черной субстанции
- гиперинтенсивное кровоизлияние: одно или двустороннее в скорлупе или наружной капсуле, таламусе
- печеночная энцефалопатия: двусторонне в бледных ядрах и черной субстанции
- гипералиментарные: двусторонне в бледных ядрах и черной субстанции
- болезнь Фабри: только подушка таламуса
- болезнь Фара: двустороннее и симетричное в базальных ядрах, таламусах, зубчатых ядрах и семиовальных центрах
- гипопаратиреоидизм, псевдопаратиреоидизм, бурые опухоли: схожие с болезнью Фара
- свинец, цианиды и отравление метанолом: двустороннее скорлупы
- нейрофиброматоз 2 типа: двустороннее бледных шаров и внутренней капсулы
- болезнь Вильсона: двустороннее в базальных ядрах и таламусах
- гипергликемия: двустороннее в хвостатых ядрах и бледных шарах
- ВИЧ инфекция: хвостатые ядра и скорлупа
- нейродегенератиный Лангергансоклеточный гистиоцитоз: скорлупа
- полушария головного мозга
- амилоидная ангиопатия, кровоизлияние в метастазы или первичную опухоль, липоматозная эпендимома, сосудистая мальформация, ушиб головного мозга, геморрагический инфаркт, кортикальный ламинарный некроз
- срединные структуры
- дермоид, тератома, липома, остеолипома, гамартома гипоталамуса, кровоизлияние в гипофиз, апоплексия гипофиза, тромбоз глубоких вен головного мозга
- супраселлярная и селлярная локализация
- гамартома гипоталамуса, дермоид, тератома, краниофариниома, киста кармана Ратке, эктопия нейрогипофиза, липома, остеолипома, тромбированная аневризма сосудов Виллизиевого круга, Лангергансоклеточный гистиоцитоз, кровоизлияние в гипофиз или его апоплексия
- желудочки
- внутрижелудочковое кровоизлияние, коллоидная киста (третьего желудочка), разрыв дермоида
- твердая мозговая оболочка
- липоматозная менингиома, кровоизлияние в метастаз, меланома, тромбоз венозных синусов
- глубокое серое вещество
Мегемоглобинсодержащие образования
Физические свойства
Внешний вид МРТ внутричерепных кровоизлияний и других поражений, содержащих продукты крови, во многом зависит от возраста гематомы. Как внутриклеточный метгемоглобин (раннее подострые фазовые кровоизлияния, через 3-7 дней после начала), так и внеклеточный метгемоглобин (поздние подострые фазовые кровоизлияния с 8 дней до 1 месяца после начала) сокращают Т1 время соседних ядер водорода в воде и других молекулах и, следовательно, имеют высокую интенсивность сигнала на T1-взвешенных изображениях. Короткое время Т1 релаксации метгемоглобина связано с парамагнитными диполь-дипольными взаимодействиями [5]. Внутриклеточный метгемоглобин имеет более короткое время T2, чем внеклеточный метгемоглобин, поэтому сравнение T1-взвешенных изображений с T2-взвешенными изображениями может помочь отличить их.
Смотрите так же отдельную публикацию Эволюция внутричерепных кровоизлияний
Амилоидная ангиопатия
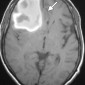
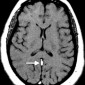
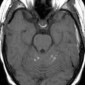
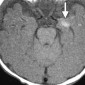
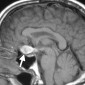
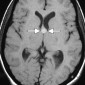
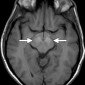
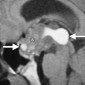
Церебральная амилоидная ангиопатия является расстройством отложения β-амилоидов в кортикальных, подкорковых и лептоменингеальных сосудах [6]. Не смотря на то, что это состояние является причиной только 2% всех внутричерепных кровоизлияний, оно относительно распространено среди пожилых людей [6]. Согласно Бостонским критериям, окончательный диагноз амилоидной ангиопатии выставляется по данным аутопсии [7]. Однако МР-томография может свидетельствовать о диагнозе. Например, петехиальные микрогеморрагии или макрогеморрагии с неправильными границами в кортикальной и подкорковой областях являются характерными находками при амилоидной ангиопатии (рис. 1). При визуализации можно наблюдать интрапаринхемальные кровоизлияния на разных стадиях эволюции, а также субарахноидальные, субдуральные и внутрижелудочковые кровоизлияния.
Кавернозные мальформации
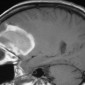
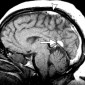
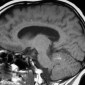
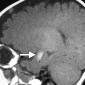
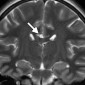
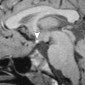
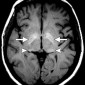
Кавернозные мальформации (кавернозные ангиомы) являются врожденными или приобретенными сосудистыми аномалиями, которые встречаются примерно в 0,5% от общей популяции [8]. Могут приводить к припадкам и неврологическому дефициту. Классические особенности, наблюдаемые при T2-взвешенном и T2*-взвешенном МР-изображении, включают образования в виде поп-корна и поясок с низким уровнем сигнала из-за осаждения гемосидерина (рис. 2a).
Подострые кровоизлияния и деградированные продукты крови в очаге вызывают ореол гиперинтенсивности сигнала вокруг образования на T1-взвешенных изображениях, полезный признак для дифференциации кавернозных мальформаций от геморрагических опухолей и других внутричерепных кровоизлияний [9] (рис. 2b)
Более поднобно читайте в отдельной публикациях - Кавернозная венозная мальформация головного мозга, Классификация церебральных кавернозных мальформаций Zabramski J.M.
Церебральный венозный тромбоз
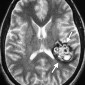
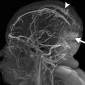
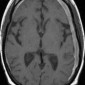
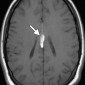
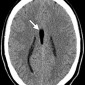
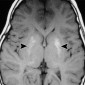
Церебральный синус-тромбоз – необычное состояние, которое чаще всего манифестирует головной болью [11]. Характерным признаком при безконтрастной компьютерной томографии (КТ) является наличие сгустка повышенной плотности, хотя эта характеристика проявляется только в примерно 20% случаев. Аналогично, признак «пустой дельты», дефект заполнения при постконтрастной КТ или КТ-венографии, присутствует менее чем в 30% случаев [12]. Выявление венозного тромбоза при МР-визуализации варьируется в зависимости от возраста тромба на момент обследования. Подострый тромб часто имеет высокую интенсивность сигнала на T1-взвешенных изображениях (рис. 3); Интенсивность сигнала на T2-взвешенных изображениях более изменчива, но также обычно высока. Градиент-эхо последовательности особенно чувствительны к парамагнитным продуктам распада крови в венозных тромбах. МР-венография эффективна для определения степени венозной окклюзии и образования коллатералей.
Меланинсодержащие образования
Физические свойства
Меланинсодержащие образования демонстрируют высокую интенсивность сигнала на T1-взвешенных изображениях из-за парамагнитных эффектов стабильных свободных радикалов, таких как семихиноны и эффекты поглощения металлов, в которых меланин связывается с хелатными ионами металлов, образуя металломеланин [13]. Было обнаружено, что интенсивность сигнала металломеланина на T1-взвешенных изображениях увеличивается с увеличением концентрации железа [14].
Метастатическая меланома
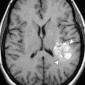
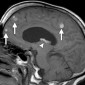
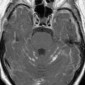
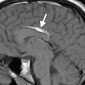
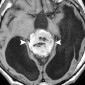
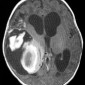
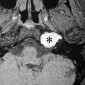
Интракраниальные метастазы встречаются почти у 40% пациентов со злокачественной меланомой [15]. По сравнению с сигналом в нормальной ткани сигнал в меланозной меланоме характеризуется высоким на T1-взвешенных изображениях и низким на T2-взвешенных изображениях (рис. 4). Высокая интенсивность сигнала также может быть результатом кровоизлияния в пределах этих повреждений. Амеланотическая метастатическая меланома проявляется либо изоинтенсивным, либо гипоинтенсивным, как в нормальной ткани на T1-взвешенных изображениях [16].
Первичный диффузный менингиальный меланоматоз
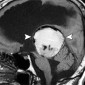
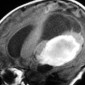
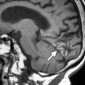
Первичный диффузный менингеальный меланоматоз является особенно агрессивной формой первичной внутричерепной меланомы. Это заболевание встречается крайне редко, заболеваемость всего 5 случаев на 100 миллионов населения в целом, и чаще встречается у взрослых, чем у детей [17,18]. Манифестация - судороги, внутричерепная гипертензия и дефицит черепных нервов [18]. Хотя в основном поражается мягкая мозговая оболочка, процесс может распространяться на твердую. Оболочки спинного мозга также часто поражаются и их следует исследовать при МР-томографии. Образования при первичном диффузном менингеальном меланоматозе проявляются средней или высокой интенсивности сигналом на Т1-взвешенных МР-изображениях (рис. 5) [17]. Тем не менее, степень распространения заболевания лучше всего оценивается при контрастном усилении. Дифференциальная диагностика включает: кровоизлияние, саркоидоз, инфекционный менингит и менингиальный карциноматоз.
Нейрокожный меланоз
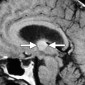
Нейрокожный меланоз - редкое врожденное состояние, характеризующееся множественными гигантскими или волосистыми пигментированными невусами и меланинсодержащими лептоменингиальными образованиями без признаков экстракраниальной меланомы [18,20]. У пациентов наблюдаются гидроцефалия, судороги или внутричерепные кровоизлияния. Меланома происходит из лептоменингиальных образований в 40-60% случаев нейрокожного меланоза [20]. Внутричерепные образования чаще наблюдаются в передних отделах височных долей (рис. 6) и в мозжечке. По сравнению с нормальной тканью, образования при нейрокожном меланозе имеют гиперинтенсивный сигнал на T1-взвешенных изображениях и гиппоинтенсивный на T2-взвешенных изображениях из-за характерных эффектов меланина. Образование трудно выявить при КТ [18]. Увеличение образования, окружающий отек, масс-эффект, узловое усиление и центральный некроз свидетельствуют о злокачественной дегенерации [18].
Липидсодержащие образования
Физика
Короткое время Т1 релаксации ядер водорода в молекулах липидов создает высокую интенсивность сигнала на Т1-взвешенных МР-изображениях [21]. Частотно-селективное подавление жира и последовательности с коротким временем инверсии-восстановления обычно используются при МР-томографии для устранения сигнала от жира. Различие частот прецессии протонов в липидах и протонах в воде также приводит к артефакту химического сдвига на границах жировой ткани и воды, что является полезным свойством в диагностической МР-томографии. При 1,5 Т этот сдвиг приводит к разнице между резонансными частотами жиров и протонов воды в 224 Гц [22]. Получаемый артефакт появляется как темная или яркая полоса вдоль границы жир-вода, в направлении кодирования частоты [22].
Внутричерепные липомы
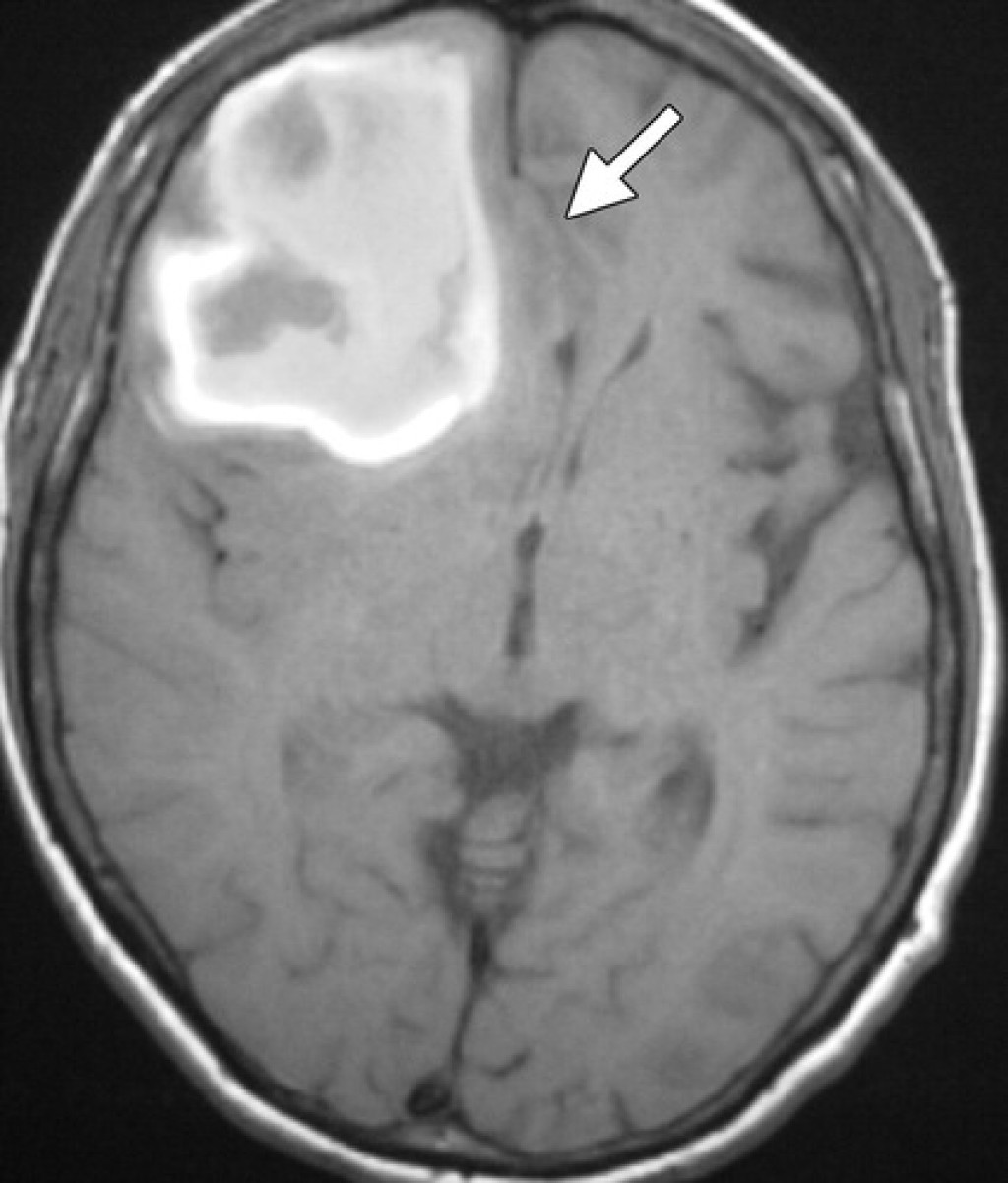
Внутричерепные липомы - это редкие врожденные пороки развития, возникающие в результате аномальной дифференциации персистирующей примитивной оболочки [23, 24]. Внутричерепные липомы чаще всего встречаются в перикалезной области [25]. Были описаны два морфологических типа перикалезных липом: тубулонодулярный и криволинейный (рис. 7). Также доброкачественные и часто бессимптомные перикалезные липомы тубулонодулярного типа, особенно с передней локализацией, часто связаны с дисгенезией или агенезией мозолистого тела [24]. Внутричерепные липомы также локализуются в области пластинки четверохолмия, цистерны четверохолмия, сильвиевой борозды и дорсальной перимезэнцефалической области. Следует отметить, что липомы в сильвиевой борозде имеют сильную связь с припадками [25]. Образования легко идентифицируются при визуализации при КТ и характерных сигналах от жировой ткани при МР-томографии, в том числе с подавлением жира [25]. Также можно видеть, что сосуды и нервы пересекаются с образованием.
Смотрите так же основную статью по данной нозологии.
Тератомы
Внутричерепные тератомы являются настоящими новообразованиями, которые обычно содержат ткань из всех трех слоев зародышевых клеток, но они также могут возникать из одного слоя зародышевых клеток, если нарушается клеточная дифференцировка [26]. Большинство внутричерепных тератомы являются доброкачественными, хотя существуют зрелые, незрелые и злокачественные варианты. В целом, тератомы являются наиболее распространенной врожденной внутричерепной опухолью и обычно диагностируются пренатально [27]. Внутричерепные тератомы чаще всего встречаются в полушариях головного мозга и шишковидной железе. При МР-томографии они обычно проявляются в виде мультилокулярных кистозных образований, которые содержат кальцинаты и жир (рис. 8).
Дермоидные кисты
Дермоидные кисты - редкие, доброкачественные, врожденные эктодермальные кисты, которые составляют приблизительно 0,3% всех внутричерепных опухолей [28,29]. Внутричерепные дермоидные кисты чаще всего встречаются по срединной линии в области турецкого седла, четвертого желудочка и червя мозжечка [29]. Образование, как правило, имеют четкую границу, не усиливаются при контрастировании, имеют низкую интенсивность жира при КТ. При МР-визуализации дермоидные кисты обычно демонстрируют высокую интенсивность сигнала на T1-взвешенных изображениях, неоднородную интенсивность сигнала на T2-взвешенных изображениях и отсутствие контрастирования на постконтрастных изображениях [29].
Разрыв дермоидной кисты - редкое осложнение, которое может вызвать тяжелый химический менингит и сенсорный или моторный гемисиндром [28,30]. Это осложнение проявляется на T1-взвешенных МР-изображениях в виде рассеянных фокусов высокой интенсивности внутри желудочков или в субарахноидальных пространствах (рис. 9) МР спектроскопия определяет высокие липидные пики на 0,9 и 1,3 ppt [28].
Более поднобно читайте в отдельной публикации - Внутричерепная дермоидная киста
Липоматозные эпендимомы
Эпендимома с липоматозной дифференцировкой является редким вариантом эпендимомы, в которой опухолевые клетки содержат жир [31,32]. Многие липоматозные эпендимомы проявляются гиперинтенсивным сигналом на T1-взвешенных изображениях (рис. 10).
Помимо этой характеристики, они проявляют обычные признаки других типов эпендимомы, включая кальцификацию, кровоизлияние и кистозные компоненты. Липоматозные эпендимомы встречаются у детей и медленно растут [32]. Однако прогноз неопределен.
Читайте также отдельную публикацию - Эпендимома
Протеинсодержащие образования
Высокая интенсивность сигнала в определенных образованиях на T1-взвешенных изображениях может быть связана с содержанием белка в них и эффектом гидратирующего слоя. Перекрёстная релаксация между белками и связанной водой влияет на скорость релаксации свободной воды [33]. Кроме того, макромолекулярная среда снижает T1 за счет замедления среднего подвижности белков [33]. В конечном счете, времена релаксации T1 и T2 зависят от количества свободной воды, содержания белка и вязкости в этих образованиях [34].
Коллоидная киста
Коллоидные кисты являются редкими доброкачественными внутричерепными опухолями, содержащими желатинообразный компонент [35]. Эти образования локализуются в передне-верхней отделе третьего желудочка и могут обтурировать отверстия Монро. Головная боль является наиболее распространенным клиническим проявлением. Другие симптомы могут включать атонические припадки, тошноту, рвоту, диплопию, временную потерю сознания и (редко) внезапную смерть [33]. При КТ большинство этих поражений показывают гиператтенуацию [29]. Может наблюдаться контрастирование по типу кольца, кальцификация встречается редко. Около двух третей коллоидных кист высоко интенсивны на T1-взвешенном МР-изображении, и большинство из них низко интенсивны на T2-взвешенном изображении (рис. 11) [29,35]. Коллоидные кисты, низко интенсивны на T1-взвешенном изображении и высоко интенсивны на T2-взвешенном изображении, имеют тенденцию к быстрому росту [29].
Читайте также - Коллоидная киста третьего желудочка
Киста кармана Ратке
Киста кармана Ратке является обычным доброкачественным остаткам кармана Ратке, которая может быть расположена селлятно, супрасаллярно или селлятно-супрасаллярно (33,36). Хотя большинство таких кист встречаются случайно, они иногда вызывают головные боли, зрительные нарушения и несахарный диабет. Около половины кист кармана Ратке проявляются гиперинтенсивным сигналом при T1-взвешенном изображении (рис. 12). Образования также часто гиперинтенсивны при Т2-взвешенной визуализации. Небольшие интракистозные включения с высокой интенсивностью сигнала при T1-взвешенном изображении и низкой интенсивности сигнала при T2-взвешенном изображении присутствуют примерно в 45% случаев (рис. 12) и считаются характерной особенностью кист Ратке [37]. Периферическое контрастное усиление иногда отмечается при МР-томографии и, вероятно, представляет собой лежащую в основе метаплазию, воспаление или осаждение гемосидерина или холестерина в стенке кисты; Однако внутреннего контрастирования никогда не наблюдалось [38]. Установлена корреляция между наличием периферического контрастного усиления и повышенным риском рецидива после хирургической резекции [38].
Более поднобно читайте в отдельной публикации - Киста кармана Ратке
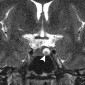
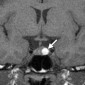
Эктопия задней доли гипофиза
Эктопия задней доли гипофиза - редкая врожденная аномалия гипоталамуса, связанная с гипоплазией или отсутствием ножки гипофиза и вторичной карликовости из-за дефицита гормона роста [39]. Это состояние может быть связано с септооптической дисплазией и перивентрикулярными гетеротопиями. Эктопированная задняя часть гипофиза наиболее часто расположена возле срединной возвышенности на дне третьего желудочка (рис. 13). Эктопия задней доли гипофиза также может быть результатом травматической или хирургической перерезки гипофизарного ножки [40,41]. Гиперинтенсивность сигнала в заднем части гипофиза на T1-взвешенных изображениях связана с парамагнитным эффектом комплекса вазопрессин-нейрофизин II-копептин [39,42,43].
Минерало-содержащие образования
Кальций и другие минералы
Кальций представляет собой диамагнитное вещество, которое может проявляться при T1-взвешенном изображении при определенных обстоятельствах. В ткани головного мозга гиперинтенсивность сигнала увеличивается в присутствии концентраций кальция 30% или менее по массе [20]. При более высоких концентрациях интенсивность сигнала от кальция на T1-взвешенном изображении уменьшается. Кроме того, время T1 релаксации возрастает с увеличением площади поверхности кальцификатов [20]. Другие минералы, которые могут иметь эффекты сокращения времени T1 релаксации - марганец, медь и железо.
Нейродегенерация с накоплением железа в головном мозге
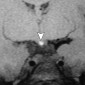
Нейродегенерация с накоплением железа в головном мозге происходит при различных нарушениях, включая ацерулоплазминемию (вызванную мутацией гена церулоплазмина), нейродегенерацию, связанную с мутацией гена пантотенаткиназы 2 (PKAN2) и гена фосфолипазы A2 (PLA2G6) [45]. Мутации PKAN2, которые ответственны за большинство случаев нейродегенерации с накоплением железа в мозге, приводят к накоплению железа в бледном шаре и черном веществе [46,47]. Это состояние проявляется клинически как прогрессирующая экстрапирамидная и пирамидальная дисфункция. На T1-взвешенном МР-изображении бедный шар с двух сторон иногда может появляться гиперинтенсивным (рис. 15a). Однако на T2-взвешенном МР-изображении двусторонние симметричные гиперинтенсивные фокусы в бледном шаре окружены ободком с низким сигналом, создавая характерный вид «глаз тигра» (рис. 15b) [46, 47].
Печеночная энцефалопатия
Печеночная энцефалопатия может привести к изменениям ментального статуса и двигательной дисфункции у пациентов с основным заболеванием печени [48].
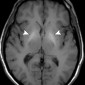
При МР-томографии печеночная энцефалопатия проявляется двусторонними областями повышенной интенсивности в лентовидном ядре и в черной субстанции на T1-взвешенных изображениях (рис. 16). Эти области с аномально высокой интенсивностью сигнала на T1-взвешенном изображении связаны с накоплением марганца у пациентов с печеночной энцефалопатией и могут встречаться также у сварщиков и при гипералиментации.
Другие находки, связанные с заболеванием печени (с или без печеночной энцефалопатии), включают диффузное повышение сигнала в белом веществе вдоль кортикоспанального тракта в одном полушарии на Т2-взвешенных изображениях, очаговые области повышения сигнала в подкорковом белом веществе на T2-взвешенных изображениях и повышенные уровни глутамина и глутамата при МР-спектроскопии, которые, вероятно, связаны с токсичностью аммиака [48]. Данные изменения в мозге, наблюдаемые при МР-томографии и МР-спектроскопии у пациентов с печеночной энцефалопатией, потенциально обратимы после трансплантации печени [49,50].
Болезнь Уилсона
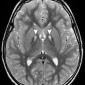
Болезнь Уилсона является редким аутосомно-рецессивным заболеванием, вызванным мутациями в гене ATP7B приводящими к аномальному метаболизму и накоплению меди [51]. Проявляется дисартрией, дистонией, тремором, хореоатетозом, отказом печени и классическими кольцами Кайзера-Флейшера при офтальмологическом обследовании. При МР-томографии церебральная атрофия и потологические сигналы обычно наблюдаются в базальных ганглиях, белом веществе мозга, среднем мозге, мосте и мозжечке.
Повышение сигнала при T1-взвешенном изображении у пациентов с болезнью Вильсона чаще всего встречается в двусторонних базальных ганглиях и вентролатеральных отделах таламусов (рис. 17).
Вовлечение полосатого ядра проявляется псевдопаркинсоническими признаками, вовлечение дентатоталамического тракта мозжечковыми признаками, вовлечение понтоцебеллярного тракта проявляется псевдопаркинсоническими признаками, а поражение белого ядра связано с портосистемным сбросом, как следствие цирроза [52]. Регрессия изменений сигнала при T1-взвешенной МР-томографии коррелирует с ответом на лечение [53]. T2-взвешенные последовательности также полезны, особенно при обнаружении повышенного сигнала в среднем мозге в сочетании с низким сигналом от верхних коен, красных ядер и частей черной субстанции; Эта комбинация находок приводит к появлению «лица гигантской панды» на аксиальных T2-взвешенных МР-изображениях [54].
Другие образования
Нейрофиброматоз 1-го типа
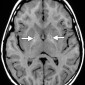
Нейрофиброматоз 1-го типа является аутосомно-доминантным нарушением гена нейрофибромина на хромосоме 17 [55]. Нейрофиброматоз 1 типа является наиболее распространенным нейрокожным синдромом [55]. Этот синдром обладает широким разнообразием внутричерепных проявлений, включая пилоцитарные астроцитомы гипоталамо-оптического нерва и ствола мозга; нейрофибромы; нейрофибросаркомы; плексиформные нейрофибромы; гидроцефалю; арахноидальные кисты; цереброваскулярные окклюзии; неопухолевые фокусы с высокой интенсивностью сигнала [56-58]. Гиперинтенсивные образования на T1-ВИ в базальных ганглиях встречаются примерно у 20% пациентов с нейрофиброматозом 1-го типа [57,58] и преимущественно включают бледный шар и внутренние капсулы симметрично с двух сторон (рис. 18). Расширение интенсивных областей по передней комиссуре напоминает форму гантели [58]. Этиология этих поражений неясна, но они могут быть связаны с гетеротопией клеток Шванна, меланином, ремиелинизацией, микрокальцинированием или их комбинацией [57-59]. Повреждения базальных ганглиев при нейрофиброматозе 1-го типа не проявляют масс-эффекта, окружающего отека и не накапливают контраст.
Более поднобно читайте в отдельной публикации - Нейрофиброматоз I типа
Холестериновая гранулема
Холестериновыми гранулемами являются доброкачественные образования, состоящие из продуктов белкового распада и кристаллов холестерина из-за распада крови, вторичного по отношению к обструкции и последующей хронической воспалительной реакции [60,61]. Эти образования чаще всего встречаются внутри вершины пирамиды, но иногда возникают в сегменте сосцевидного отростка, среднем ухе и в глазничнолобной области [61, 62]. При достаточно увеличенном увеличении гранулемы холестерина могут вызывать расщепление кости с последующим внутричерепным ростом [61]. Пациенты чаще всего страдают головной болью и потерей слуха [63]. Как правило, гранулемы холестерина появляются как гладкие, четко определенные однородные образования, которые проявляют высокую интенсивность сигнала на T1-взвешенном изображении (рис. 19). Высокий сигнал на Т1-ВИ этих поражений не зависит от последовательностей подавления жира [62]. Холестериновые гранулемы также часто являются гиперинтенсивными на T2-взвешенном изображении и могут иметь гипоинтенсивный ободок в результате отношения гемосидерина [61]. Лечение симптоматических образований заключается в хирургическом удалении, дренаже или стентировании [60]. После успешного дренирования холестериновые гранулемы теряют свою гиперинтенсивность на T1, тогда как повторяющиеся образования, как правило, остаются гиперинтенсивными [64].
Краниофарингиома
Краниофарингиомы являются доброкачественными новообразованиями, происходящими из эпителиальных остатков в кармане Ратке [65]. Основными гистопатологическими подтипами являются папиллярные, адамантиматозные и смешанные краниофарингиомы. Папиллярные краниофарингиомы имеют тенденцию быть твердыми и встречаются у взрослых, тогда как адамантиматозный тип имеет тенденцию быть кистозным и встречается у детей. Хотя большинство краниофарингиом расположены в супрасаллярной области, около половины имеют также интраселлярный компонент [66]. По оценкам, 90% краниофарингиом содержат кальцификаты, которые видны при КТ, и кистозный компонент, который иногда проявляется в виде гиперинтенсивного сигнала на T1-взвешенных изображениях (рис. 20) [67]. Гиперинтенсивность T1, наблюдаемая в кистозных компонентах краниофарингиомы, объясняется наличием белка, гранул холестерина и метгемоглобина [35]. Кистозный компонент краниофарингиом также часто проявляется как высокий сигнал на T2-ВИ и проявляет кольцевидный тип накопления КС на постконтрастных T1-взвешенных изображениях [68].
Более поднобно читайте в отдельной публикации - Краниофарингиома
Ламинарный некроз коры головного мозга
Ламинарный некроз коры является следствием глобального гипоксического ишемического события или, реже, как эффект иммуносупрессивной терапии или химиотерапии [69]. Третий слой коры особенно восприимчив к гипоксии и недостатку глюкозы [70]. При МР-томографии последовательно наблюдаются характерные серии изменений: кортикальные образования с высокой интенсивностью сигнала появляются на T1-ВИ примерно через 2 недели после возбуждающего события и становятся все более заметными через 1-2 месяца после события, а также максимально накапливает контраст (Рис. 21) [71]. Гиперинтенсивность сигнала T1 обычно исчезает через 2 года, тогда как атрофия паренхимы прогрессирует. Повышение интенсивности сигнала, наблюдаемая на T1- взвешенных изображениях, может быть связана с минерализацией, денатурацией белка или липидном перерождении [72]. Однако метгемоглобин, по-видимому, не вносит вклад в эту гиперинтенсивность сигнала [73].
Выводы
Разнообразные категории внутричерепных поражений выглядят гиперинтенсивными на Т1-взвешенном МР-изображении. Знакомство с типами веществ и физическими свойствами, которые способствуют сокращению времени T1, полезно для формулировки соответствующего дифференциально диагностического ряда и систематического подхода к интерпретации изображений с высокой интенсивностью сигнала, наблюдаемых на изображениях с взвешенным T1. Многие заболевания имеют характерные клинические и визуальные признаки, которые позволяют предположить окончательный диагноз.
Литература
- Jacobs MA, Ibrahim TS, Ouwerkerk R. AAPM/RSNA physics tutorials for residents: MR imaging: brief overview and emerging applications. Radiographics : a review publication of the Radiological Society of North America, Inc. 27 (4): 1213-29. doi:10.1148/rg.274065115 - Pubmed
- Bitar R, Leung G, Perng R, Tadros S, Moody AR, Sarrazin J, McGregor C, Christakis M, Symons S, Nelson A, Roberts TP. MR pulse sequences: what every radiologist wants to know but is afraid to ask. Radiographics : a review publication of the Radiological Society of North America, Inc. 26 (2): 513-37. doi:10.1148/rg.262055063 - Pubmed
- Takahashi M, Uematsu H, Hatabu H. MR imaging at high magnetic fields. European journal of radiology. 46 (1): 45-52. Pubmed
- Maubon AJ, Ferru JM, Berger V, Soulage MC, DeGraef M, Aubas P, Coupeau P, Dumont E, Rouanet JP. Effect of field strength on MR images: comparison of the same subject at 0.5, 1.0, and 1.5 T. Radiographics : a review publication of the Radiological Society of North America, Inc. 19 (4): 1057-67. doi:10.1148/radiographics.19.4.g99jl281057 - Pubmed
- Bradley WG. MR appearance of hemorrhage in the brain. Radiology. 189 (1): 15-26. doi:10.1148/radiology.189.1.8372185 - Pubmed
- Chao CP, Kotsenas AL, Broderick DF. Cerebral amyloid angiopathy: CT and MR imaging findings. Radiographics : a review publication of the Radiological Society of North America, Inc. 26 (5): 1517-31. doi:10.1148/rg.265055090 - Pubmed
- Knudsen KA, Rosand J, Karluk D, Greenberg SM. Clinical diagnosis of cerebral amyloid angiopathy: validation of the Boston criteria. Neurology. 56 (4): 537-9. Pubmed
- Zabramski JM, Wascher TM, Spetzler RF, Johnson B, Golfinos J, Drayer BP, Brown B, Rigamonti D, Brown G. The natural history of familial cavernous malformations: results of an ongoing study. Journal of neurosurgery. 80 (3): 422-32. doi:10.3171/jns.1994.80.3.0422 - Pubmed
- Yun TJ, Na DG, Kwon BJ, Rho HG, Park SH, Suh YL, Chang KH. A T1 hyperintense perilesional signal aids in the differentiation of a cavernous angioma from other hemorrhagic masses. AJNR. American journal of neuroradiology. 29 (3): 494-500. doi:10.3174/ajnr.A0847 - Pubmed
- Petersen TA, Morrison LA, Schrader RM, Hart BL. Familial versus sporadic cavernous malformations: differences in developmental venous anomaly association and lesion phenotype. AJNR. American journal of neuroradiology. 31 (2): 377-82. doi:10.3174/ajnr.A1822 - Pubmed
- Isensee C, Reul J, Thron A. Magnetic resonance imaging of thrombosed dural sinuses. Stroke. 25 (1): 29-34. Pubmed
- Poon CS, Chang JK, Swarnkar A, Johnson MH, Wasenko J. Radiologic diagnosis of cerebral venous thrombosis: pictorial review. AJR. American journal of roentgenology. 189 (6 Suppl): S64-75. doi:10.2214/AJR.07.7015 - Pubmed
- Isiklar I, Leeds NE, Fuller GN, Kumar AJ. Intracranial metastatic melanoma: correlation between MR imaging characteristics and melanin content. AJR. American journal of roentgenology. 165 (6): 1503-12. doi:10.2214/ajr.165.6.7484597 - Pubmed
- Enochs WS, Petherick P, Bogdanova A, Mohr U, Weissleder R. Paramagnetic metal scavenging by melanin: MR imaging. Radiology. 204 (2): 417-23. doi:10.1148/radiology.204.2.9240529 - Pubmed
- Leach JL, Fortuna RB, Jones BV, Gaskill-Shipley MF. Imaging of cerebral venous thrombosis: current techniques, spectrum of findings, and diagnostic pitfalls. Radiographics : a review publication of the Radiological Society of North America, Inc. 26 Suppl 1: S19-41; discussion S42-3. doi:10.1148/rg.26si055174 - Pubmed
- Escott EJ. A variety of appearances of malignant melanoma in the head: a review. Radiographics : a review publication of the Radiological Society of North America, Inc. 21 (3): 625-39. doi:10.1148/radiographics.21.3.g01ma19625 - Pubmed
- Liubinas SV, Maartens N, Drummond KJ. Primary melanocytic neoplasms of the central nervous system. Journal of clinical neuroscience : official journal of the Neurosurgical Society of Australasia. 17 (10): 1227-32. doi:10.1016/j.jocn.2010.01.017 - Pubmed
- Smith AB, Rushing EJ, Smirniotopoulos JG. Pigmented lesions of the central nervous system: radiologic-pathologic correlation. Radiographics : a review publication of the Radiological Society of North America, Inc. 29 (5): 1503-24. doi:10.1148/rg.295095109 - Pubmed
- Pirini MG, Mascalchi M, Salvi F, Tassinari CA, Zanella L, Bacchini P, Bertoni F, D'Errico A, Corti B, Grigioni WF. Primary diffuse meningeal melanomatosis: radiologic-pathologic correlation. AJNR. American journal of neuroradiology. 24 (1): 115-8. Pubmed
- Henkelman RM, Watts JF, Kucharczyk W. High signal intensity in MR images of calcified brain tissue. Radiology. 179 (1): 199-206. doi:10.1148/radiology.179.1.1848714 - Pubmed
- Warakaulle DR, Anslow P. Differential diagnosis of intracranial lesions with high signal on T1 or low signal on T2-weighted MRI. Clinical radiology. 58 (12): 922-33. Pubmed
- Hood MN, Ho VB, Smirniotopoulos JG, Szumowski J. Chemical shift: the artifact and clinical tool revisited. Radiographics : a review publication of the Radiological Society of North America, Inc. 19 (2): 357-71. doi:10.1148/radiographics.19.2.g99mr07357 - Pubmed
- Truwit CL, Barkovich AJ. Pathogenesis of intracranial lipoma: an MR study in 42 patients. AJR. American journal of roentgenology. 155 (4): 855-64; discussion 865. doi:10.2214/ajr.155.4.2119122 - Pubmed
- Jabot G, Stoquart-Elsankari S, Saliou G, Toussaint P, Deramond H, Lehmann P. Intracranial lipomas: clinical appearances on neuroimaging and clinical significance. Journal of neurology. 256 (6): 851-5. doi:10.1007/s00415-009-5087-5 - Pubmed
- Yildiz H, Hakyemez B, Koroglu M, Yesildag A, Baykal B. Intracranial lipomas: importance of localization. Neuroradiology. 48 (1): 1-7. doi:10.1007/s00234-005-0001-z - Pubmed
- Smirniotopoulos JG, Chiechi MV. Teratomas, dermoids, and epidermoids of the head and neck. Radiographics : a review publication of the Radiological Society of North America, Inc. 15 (6): 1437-55. doi:10.1148/radiographics.15.6.8577967 - Pubmed
- Isaacs H. I. Perinatal brain tumors: a review of 250 cases. Pediatric neurology. 27 (4): 249-61. Pubmed
- Liu JK, Gottfried ON, Salzman KL, Schmidt RH, Couldwell WT. Ruptured intracranial dermoid cysts: clinical, radiographic, and surgical features. Neurosurgery. 62 (2): 377-84; discussion 384. doi:10.1227/01.neu.0000316004.88517.29 - Pubmed
- Osborn AG, Preece MT. Intracranial cysts: radiologic-pathologic correlation and imaging approach. Radiology. 239 (3): 650-64. doi:10.1148/radiol.2393050823 - Pubmed
- Stendel R, Pietilä TA, Lehmann K, Kurth R, Suess O, Brock M. Ruptured intracranial dermoid cysts. Surgical neurology. 57 (6): 391-8; discussion 398. Pubmed
- Ruchoux MM, Kepes JJ, Dhellemmes P, Hamon M, Maurage CA, Lecomte M, Gall CM, Chilton J. Lipomatous differentiation in ependymomas: a report of three cases and comparison with similar changes reported in other central nervous system neoplasms of neuroectodermal origin. The American journal of surgical pathology. 22 (3): 338-46. Pubmed
- Chang WE, Finn LS. MR appearance of lipomatous ependymoma in a 5-year-old boy. AJR. American journal of roentgenology. 177 (6): 1475-8. doi:10.2214/ajr.177.6.1771475 - Pubmed
- Fullerton GD, Finnie MF, Hunter KE, Ord VA, Cameron IL. The influence of macromolecular polymerization of spin-lattice relaxation of aqueous solutions. Magnetic resonance imaging. 5 (5): 353-70. Pubmed
- Som PM, Dillon WP, Fullerton GD, Zimmerman RA, Rajagopalan B, Marom Z. Chronically obstructed sinonasal secretions: observations on T1 and T2 shortening. Radiology. 172 (2): 515-20. doi:10.1148/radiology.172.2.2748834 - Pubmed
- Armao D, Castillo M, Chen H, Kwock L. Colloid cyst of the third ventricle: imaging-pathologic correlation. AJNR. American journal of neuroradiology. 21 (8): 1470-7. Pubmed
- Sumida M, Uozumi T, Mukada K, Arita K, Kurisu K, Eguchi K. Rathke cleft cysts: correlation of enhanced MR and surgical findings. AJNR. American journal of neuroradiology. 15 (3): 525-32. Pubmed
- Binning MJ, Gottfried ON, Osborn AG, Couldwell WT. Rathke cleft cyst intracystic nodule: a characteristic magnetic resonance imaging finding. Journal of neurosurgery. 103 (5): 837-40. doi:10.3171/jns.2005.103.5.0837 - Pubmed
- Kim JE, Kim JH, Kim OL, Paek SH, Kim DG, Chi JG, Jung HW. Surgical treatment of symptomatic Rathke cleft cysts: clinical features and results with special attention to recurrence. Journal of neurosurgery. 100 (1): 33-40. doi:10.3171/jns.2004.100.1.0033 - Pubmed
- Mitchell LA, Thomas PQ, Zacharin MR, Scheffer IE. Ectopic posterior pituitary lobe and periventricular heterotopia: cerebral malformations with the same underlying mechanism?. AJNR. American journal of neuroradiology. 23 (9): 1475-81. Pubmed
- van der Linden AS, van Es HW. Case 112: pituitary stalk transection syndrome with ectopic posterior pituitary gland. Radiology. 243 (2): 594-7. doi:10.1148/radiol.2432040385 - Pubmed
- Fujisawa I, Kikuchi K, Nishimura K, Togashi K, Itoh K, Noma S, Minami S, Sagoh T, Hiraoka T, Momoi T. Transection of the pituitary stalk: development of an ectopic posterior lobe assessed with MR imaging. Radiology. 165 (2): 487-9. doi:10.1148/radiology.165.2.3659371 - Pubmed
- Castillo M. Pituitary gland: development, normal appearances, and magnetic resonance imaging protocols. Topics in magnetic resonance imaging : TMRI. 16 (4): 259-68. doi:10.1097/01.rmr.0000224682.91253.15 - Pubmed
- Kurokawa H, Fujisawa I, Nakano Y, Kimura H, Akagi K, Ikeda K, Uokawa K, Tanaka Y. Posterior lobe of the pituitary gland: correlation between signal intensity on T1-weighted MR images and vasopressin concentration. Radiology. 207 (1): 79-83. doi:10.1148/radiology.207.1.9530302 - Pubmed
- Koob M, Laugel V, Durand M, Fothergill H, Dalloz C, Sauvanaud F, Dollfus H, Namer IJ, Dietemann JL. Neuroimaging in Cockayne syndrome. AJNR. American journal of neuroradiology. 31 (9): 1623-30. doi:10.3174/ajnr.A2135 - Pubmed
- McNeill A, Chinnery PF. Neurodegeneration with brain iron accumulation. Handbook of clinical neurology. 100: 161-72. doi:10.1016/B978-0-444-52014-2.00009-4 - Pubmed
- Sener RN. Pantothenate kinase-associated neurodegeneration: MR imaging, proton MR spectroscopy, and diffusion MR imaging findings. AJNR. American journal of neuroradiology. 24 (8): 1690-3. Pubmed
- Hayflick SJ, Hartman M, Coryell J, Gitschier J, Rowley H. Brain MRI in neurodegeneration with brain iron accumulation with and without PANK2 mutations. AJNR. American journal of neuroradiology. 27 (6): 1230-3. Pubmed
- Rovira A, Alonso J, Córdoba J. MR imaging findings in hepatic encephalopathy. AJNR. American journal of neuroradiology. 29 (9): 1612-21. doi:10.3174/ajnr.A1139 - Pubmed
- Pujol A, Pujol J, Graus F, Rimola A, Peri J, Mercader JM, García-Pagan JC, Bosch J, Rodés J, Tolosa E. Hyperintense globus pallidus on T1-weighted MRI in cirrhotic patients is associated with severity of liver failure. Neurology. 43 (1): 65-9. Pubmed
- Pujol J, Kulisevsky J, Moreno A, Deus J, Alonso J, Balanzó J, Martí-Vilalta JL, Capdevila A. Neurospectroscopic alterations and globus pallidus hyperintensity as related magnetic resonance markers of reversible hepatic encephalopathy. Neurology. 47 (6): 1526-30. Pubmed
- Lorincz MT. Neurologic Wilson's disease. Annals of the New York Academy of Sciences. 1184: 173-87. doi:10.1111/j.1749-6632.2009.05109.x - Pubmed
- van Wassenaer-van Hall HN, van den Heuvel AG, Algra A, Hoogenraad TU, Mali WP. Wilson disease: findings at MR imaging and CT of the brain with clinical correlation. Radiology. 198 (2): 531-6. doi:10.1148/radiology.198.2.8596862 - Pubmed
- Kim TJ, Kim IO, Kim WS, Cheon JE, Moon SG, Kwon JW, Seo JK, Yeon KM. MR imaging of the brain in Wilson disease of childhood: findings before and after treatment with clinical correlation. AJNR. American journal of neuroradiology. 27 (6): 1373-8. Pubmed
- Thapa R, Ghosh A. 'Face of the giant panda' sign in Wilson disease. Pediatric radiology. 38 (12): 1355. doi:10.1007/s00247-008-1017-4 - Pubmed
- Williams VC, Lucas J, Babcock MA, Gutmann DH, Korf B, Maria BL. Neurofibromatosis type 1 revisited. Pediatrics. 123 (1): 124-33. doi:10.1542/peds.2007-3204 - Pubmed
- Jacques C, Dietemann JL. [Imaging features of neurofibromatosis type 1]. Journal of neuroradiology. Journal de neuroradiologie. 32 (3): 180-97. Pubmed
- Terada H, Barkovich AJ, Edwards MS, Ciricillo SM. Evolution of high-intensity basal ganglia lesions on T1-weighted MR in neurofibromatosis type 1. AJNR. American journal of neuroradiology. 17 (4): 755-60. Pubmed
- Mirowitz SA, Sartor K, Gado M. High-intensity basal ganglia lesions on T1-weighted MR images in neurofibromatosis. AJR. American journal of roentgenology. 154 (2): 369-73. doi:10.2214/ajr.154.2.2105032 - Pubmed
- DiPaolo DP, Zimmerman RA, Rorke LB, Zackai EH, Bilaniuk LT, Yachnis AT. Neurofibromatosis type 1: pathologic substrate of high-signal-intensity foci in the brain. Radiology. 195 (3): 721-4. doi:10.1148/radiology.195.3.7754001 - Pubmed
- Royer MC, Pensak ML. Cholesterol granulomas. Current opinion in otolaryngology & head and neck surgery. 15 (5): 319-22. doi:10.1097/MOO.0b013e3282a08f74 - Pubmed
- Chapman PR, Shah R, Curé JK, Bag AK. Petrous apex lesions: pictorial review. AJR. American journal of roentgenology. 196 (3 Suppl): WS26-37 Quiz S40-3. doi:10.2214/AJR.10.7229 - Pubmed
- Chow LP, McNab AA. Orbitofrontal cholesterol granuloma. Journal of clinical neuroscience : official journal of the Neurosurgical Society of Australasia. 12 (2): 206-9. doi:10.1016/j.jocn.2003.09.006 - Pubmed
- Thedinger BA, Nadol JB, Montgomery WW, Thedinger BS, Greenberg JJ. Radiographic diagnosis, surgical treatment, and long-term follow-up of cholesterol granulomas of the petrous apex. The Laryngoscope. 99 (9): 896-907. doi:10.1288/00005537-198909000-00003 - Pubmed
- Greenberg JJ, Oot RF, Wismer GL, Davis KR, Goodman ML, Weber AE, Montgomery WW. Cholesterol granuloma of the petrous apex: MR and CT evaluation. AJNR. American journal of neuroradiology. 9 (6): 1205-14. Pubmed
- Prabhu VC, Brown HG. The pathogenesis of craniopharyngiomas. Child's nervous system : ChNS : official journal of the International Society for Pediatric Neurosurgery. 21 (8-9): 622-7. doi:10.1007/s00381-005-1190-9 - Pubmed
- Zada G, Lin N, Ojerholm E, Ramkissoon S, Laws ER. Craniopharyngioma and other cystic epithelial lesions of the sellar region: a review of clinical, imaging, and histopathological relationships. Neurosurgical focus. 28 (4): E4. doi:10.3171/2010.2.FOCUS09318 - Pubmed
- Curran JG, O'Connor E. Imaging of craniopharyngioma. Child's nervous system : ChNS : official journal of the International Society for Pediatric Neurosurgery. 21 (8-9): 635-9. doi:10.1007/s00381-005-1245-y - Pubmed
- Ahmadi J, Destian S, Apuzzo ML, Segall HD, Zee CS. Cystic fluid in craniopharyngiomas: MR imaging and quantitative analysis. Radiology. 182 (3): 783-5. doi:10.1148/radiology.182.3.1535894 - Pubmed
- Bargalló N, Burrel M, Berenguer J, Cofan F, Buñesch L, Mercader JM. Cortical laminar necrosis caused by immunosuppressive therapy and chemotherapy. AJNR. American journal of neuroradiology. 21 (3): 479-84. Pubmed
- Kuroiwa T, Okeda R. Neuropathology of cerebral ischemia and hypoxia: recent advances in experimental studies on its pathogenesis. Pathology international. 44 (3): 171-81. Pubmed
- Siskas N, Lefkopoulos A, Ioannidis I, Charitandi A, Dimitriadis AS. Cortical laminar necrosis in brain infarcts: serial MRI. Neuroradiology. 45 (5): 283-8. doi:10.1007/s00234-002-0887-7 - Pubmed
- Shan DE. Delayed ischemic hyperintensity of T1-weighted MRI. Stroke. 31 (3): 797-8. Pubmed
- Niwa T, Aida N, Shishikura A, Fujita K, Inoue T. Susceptibility-weighted imaging findings of cortical laminar necrosis in pediatric patients. AJNR. American journal of neuroradiology. 29 (9): 1795-8. doi:10.3174/ajnr.A1184 - Pubmed
- Ginat DT, Meyers SP. Intracranial lesions with high signal intensity on T1-weighted MR images: differential diagnosis. Radiographics : a review publication of the Radiological Society of North America, Inc. 32 (2): 499-516. doi:10.1148/rg.322105761 - Pubmed